Front Biosci:郑州大学第一附属医院探索低能量激光对牙髓干细胞增殖的影响及其机制的初步研究
2024-07-01 医路坦克 MedSci原创 发表于上海
牙髓干细胞(DPSCs)具有自我更新和多向分化的潜能。因此,DPSCs具有广泛的临床应用。低水平激光治疗对细胞增殖、血管生成、成骨分化、骨再生和骨折愈合具有积极的光生物刺激作用。
牙髓组织是整个牙齿的营养来源,在牙齿发育和损伤修复中起着至关重要的作用。然而,它极易受到创伤和细菌感染,导致不可逆的牙髓炎和根尖周炎症。传统的临床治疗方法是根管治疗,包括去除牙髓组织,对根管进行清洁、整形、消毒和灭菌,然后紧紧地填充根管。然而,除牙髓后,整个牙齿就失去了营养来源。这会增加牙组织的脆性,不利于幼龄恒牙牙根的发育。因此,保持牙髓活力对保护牙齿组织至关重要。

再生牙髓治疗(regenerative endodontic treatment, RET)的概念最早由Murray等人于2007年提出。牙源性间充质干细胞在RET中起着至关重要的作用。当牙髓或牙周组织遭受创伤或炎症时,由于缺乏足够的干细胞,组织无法自我修复。在这些条件下,干细胞的体外扩增可以为促进组织修复和再生提供细胞来源。
低水平激光治疗(LLLT)在红外至近红外波长范围内(600 - 1200nm),功率< 500mw,在临床上常用。LLLT在体外促进干细胞的增殖和分化,因此可能在体内再生过程和组织工程方案中发挥重要作用。LLLT的主要生理作用与其刺激不同细胞类型增殖的能力有关。研究表明,LLLT可促进牙周干细胞、牙髓干细胞(DPSCs)、骨髓间充质干细胞等的增殖。因此,DPSCs在再生医学中的临床应用潜力非常大。此外,用LLLT治疗牙髓细胞/组织后再进行保守治疗(切髓或直接盖髓)可以增加III期牙本质沉积、细胞活力和细胞增殖。然而,LLLT对干细胞生物刺激作用的内在分子机制尚不清楚。这可能是目前阻碍其发展的原因之一。
在本研究中,我们探讨了LLLT对体外培养的DPSCs增殖能力的影响。研究其内在的分子机制,为LLLT的临床应用提供实验依据。
方法:从牙髓组织中提取DPSCs。通过体外培养和激光照射研究LLLT对DPSCs增殖的影响及其机制。
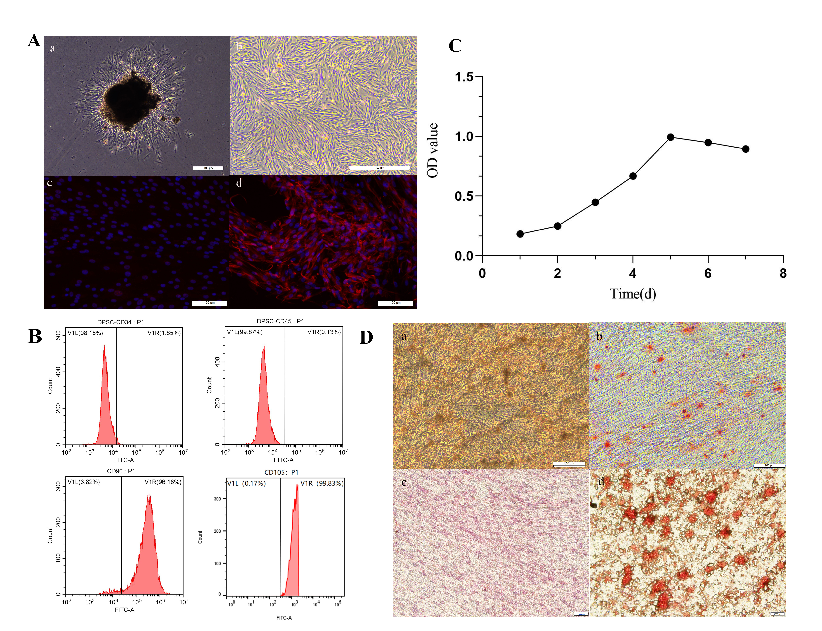
牙髓干细胞的分离、培养和鉴定。(A) DPSCs原代培养(比例尺:100µm)。(a)从组织块边缘生长出来的DPSCs。(b) P1代DPSCs,显示漩涡状生长模式和高达90%的融合。(c) DPSCs角蛋白染色阴性。(d) DPSCs波形蛋白染色阳性。(B) DPSCs的流式细胞术结果。(C) DPSCs的生长曲线。(D) (a,b) DPSCs成骨能力的鉴定。(a)对照组(比例尺:200µm)。(b)矿化诱导溶液刺激后的实验组(标尺:100µm)。茜素红染色显示矿化结节斑块。(c,d)鉴定DPSCs的脂质生成能力。(c)对照组(比例尺:1000µm)。(d)致脂溶液刺激后的实验组(比例尺:1000µm)。油红O染色显示橙红色的脂滴。
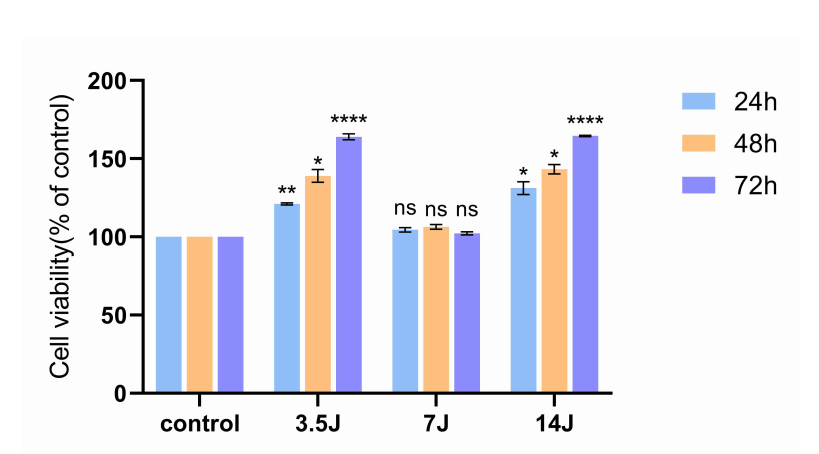
低水平激光治疗(LLLT)对DPSCs增殖的影响
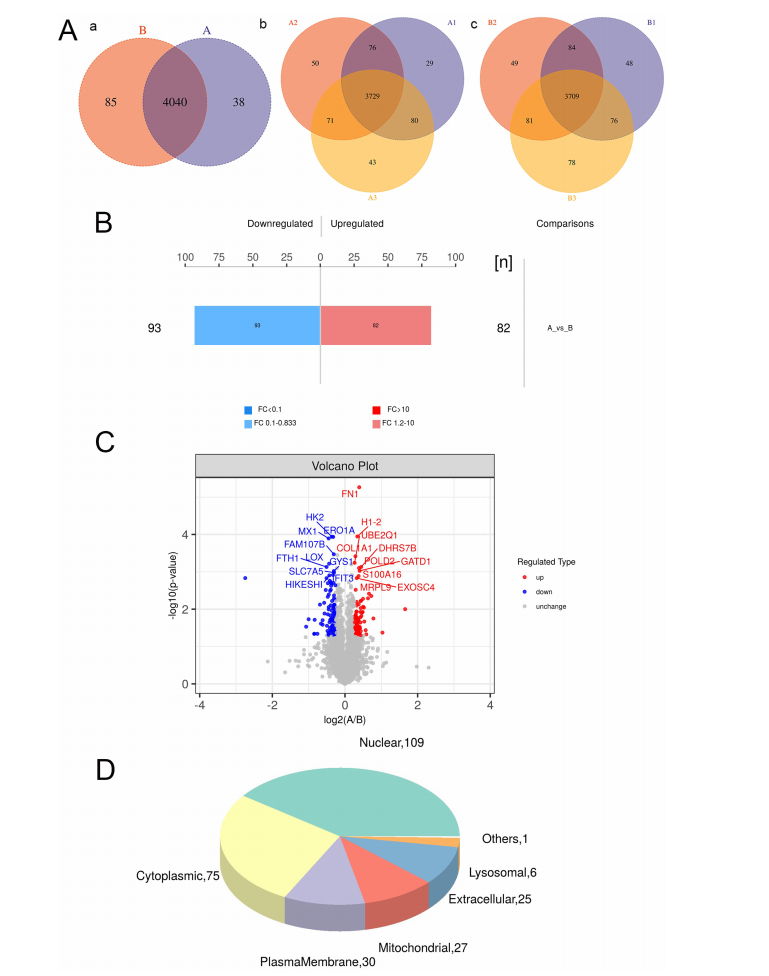
LLLT照射后DPSCs蛋白表达谱的变化。(A)组内样品蛋白重叠。(a)所有样品组中鉴定的蛋白质。(b) 3.5 J/cm2样品组中鉴定的蛋白。(c) 0 J/cm2样品组中鉴定的蛋白质。(B)以0 J/cm2(对照)和3.5 J/cm2(实验)能量密度照射DPSCs后差异表达蛋白的定量结果柱状图。(C) 0 J/cm2和3.5 J/cm2能量密度照射后DPSCs差异表达蛋白的火山图。(D)饼状图显示了0 J/cm2和3.5 J/cm2能量密度照射后DPSCs中差异表达蛋白的亚细胞定位。
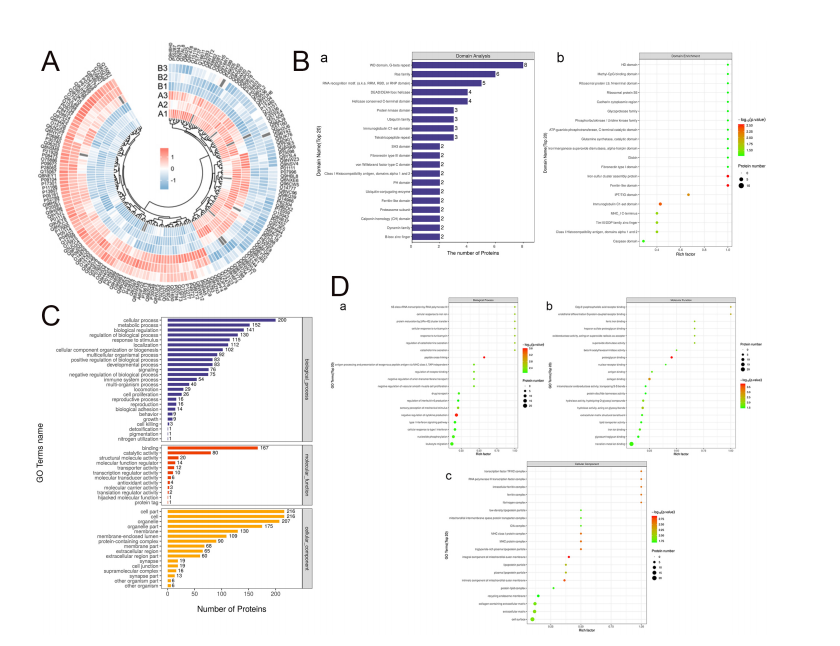
0 J/cm2(对照组)和3.5 J/cm2(实验组)能量密度照射后DPSCs差异表达蛋白的富集分析。(A)差异表达蛋白的聚类分析。(B) (a)差异表达蛋白结构域分析和(B)富集分析。(C) Gene Ontology (GO, http://www.geneontology.org/)标注了差异表达蛋白的统计图谱(水平2)。(D) (a) Biological Process (BP), (b) Molecular Function (MF), (C) Cellular Component (CC)下GO功能富集的气泡图。
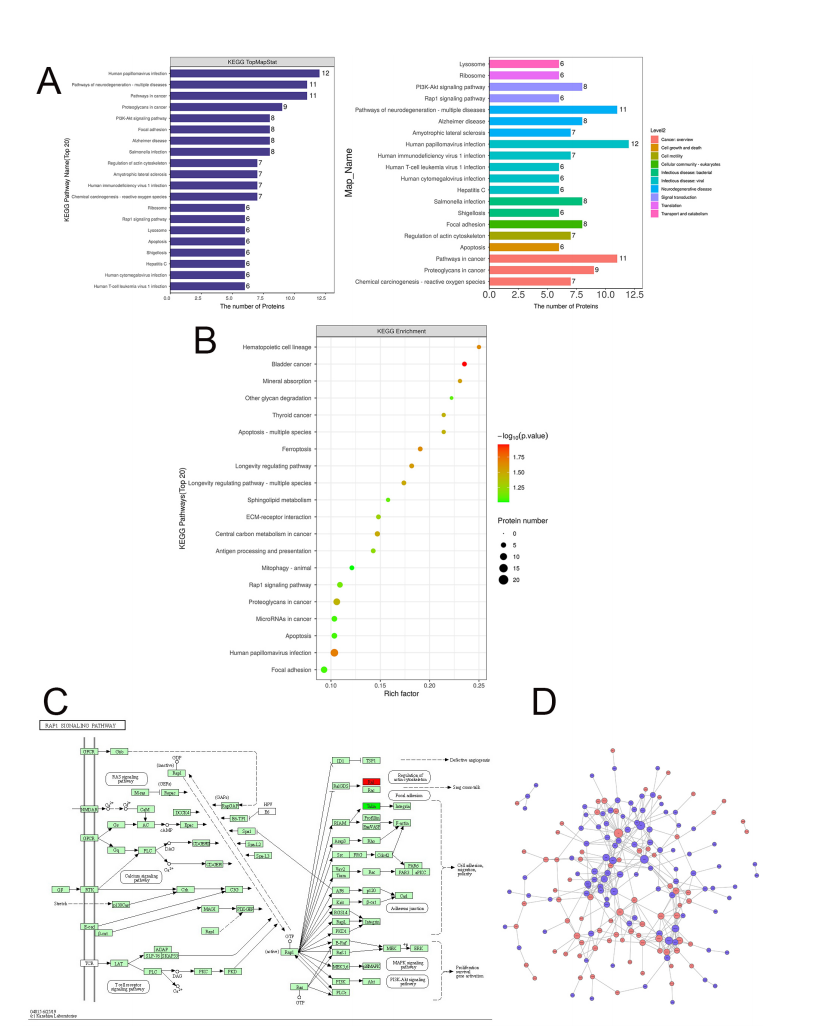
能量密度为0 J/cm2或3.5 J/cm2的DPSC组间差异表达蛋白的信号通路分析。(A)京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)途径差异表达蛋白的注释统计图(Top20)。(B)差异表达蛋白的KEGG通路富集气泡图。(C)差异表达蛋白的KEGG通路图示例。(D)差异表达蛋白相互作用的网络图。
结果:能量密度分别为3.5 J/cm2和14 J/cm2的LLLT促进了DPSCs的增殖。差异蛋白表达研究表明,LLLT刺激DPSC增殖涉及PI3K-Akt和Rap1信号通路,以及凋亡相关通路。
结论:本初步研究表明,低能量激光对DPSCs具有促增殖作用,并确定了可能的相关机制。我们的研究结果为DPSCs的临床应用提供了理论基础,并为相关疾病的治疗提供了新的策略。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#低能量激光# #牙髓干细胞增殖#
21